体外重建患者的肿瘤器官什么鬼?乳腺癌精准治疗重大突破!
时间:2021-10-12 14:02:09 热度:37.1℃ 作者:网络
乳腺癌是全世界妇女中最常见的诊断癌症。尽管实施了筛查方案并改进了治疗方法使乳腺癌患者生存率显著提高,但2020年仍有68.5万乳腺癌相关死亡,使其成为妇女癌症主要死因。乳腺癌治疗方法的选择在很大程度上取决于肿瘤的临床和分子特性。全身化疗、内分泌治疗和人类表皮生长因子受体2(HER2)靶向治疗是乳腺癌治疗中最广泛使用的手段。由于乳腺癌的异质性特征,一定比例的患者最终发展成复发性疾病,并表现出对初始治疗的耐药性。转移则是乳腺癌治疗的另一个重大挑战。复发性或转移性乳腺癌的侵袭性性和高死亡率表明,我们急需更精确地进行治疗。

最近研究已开发出患者衍生器官(PDOs),有望作为人类癌症的模型系统。结果表明,PDOs可以在短时间内从患者肿瘤中提取,成功率高,能够准确概括其亲代肿瘤的结构和生物学特征。迄今为止,已经成功地建立了广泛的癌症PDO模型,这不仅有助于更好地了解癌症生物学,且为体外治疗疗效测试提供了理想的模型。然而,患有晚期疾病的乳腺癌患者能否从基于PDOs的药物测试中受益尚未明确。在本研究中旨在探索乳腺癌PDO在癌症精准治疗方面的应用。

1、患者数据
从中国5家医院接受治疗的125名女性患者中,共获得132份乳腺癌组织。77份样本来自初治患者。耐药患者处获得23个样本。转移性乳腺癌样本来自淋巴结(n = 6)、肺(n = 6)、胸壁(n = 5)、骨(n = 3)、肝脏(n = 4)和性腺(n = 1)。所有患者都接受了标准治疗,包括内分泌治疗、局部放射治疗、治疗性手术和化疗。
2、建立患者衍生乳腺癌器官(PDO)
最终从132个乳腺癌样本中建立了99个器官,总体成功率为75%(图1A)。冷冻样品成功率低于新鲜样品。在临床治疗期间,有一部分患者接受了活检,我们还试图从这些小样本中生成器官。活检肿瘤主要从药物治疗的患者(17例中有14例,82%)和76%(17例中的13例)来自转移部位。早期一代的长期培养通常是需要从这些标本中建立器官系。我们最终从这些活检肿瘤(n = 17)中生成了11个器官,成功率为65%。此外,我们发现在某些情况下,PDOs的生长在第2代后减少。
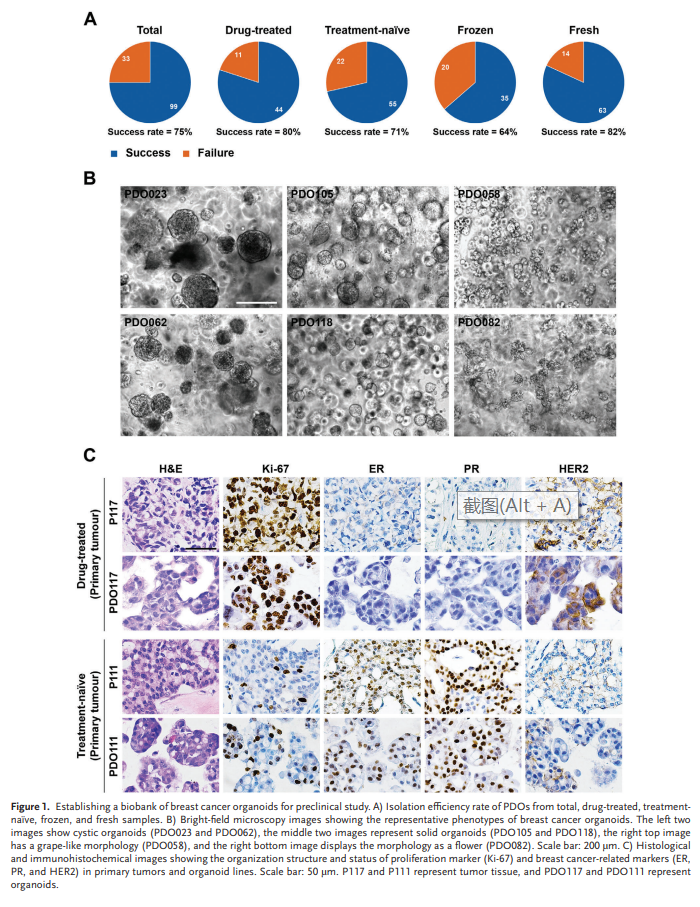
形态学观察表明,大多数乳腺癌类器官具有囊性或实性结构,少数病例显示葡萄状形态(图1B)。经治和未治患者的器官系之间未见显著形态差异。总的来说,本研究成功地建立了人类乳腺癌类器官生物库,并制定了收集和长期保存战略。
3、乳腺癌PDOs囊括亲代肿瘤的组织病理学和遗传特征
在12对乳腺癌类器官和亲代肿瘤中比较了组织病理特征(通道1-2)。我们发现,从药物治疗及未经治疗肿瘤中建立的器官系都继承了亲代肿瘤的组织特征(图1C)。随后评估ER、PR和HER2,和Ki-67状态。免疫组化化染色结果表明,乳腺癌标志物的表达模式在药物治疗和未经治疗肿瘤衍生器官中保存完好(图1C)。我们还对四条已建立的长期培养乳腺癌器官系进行了免疫组织化学分析。在长期培养之后,ER/PR 和 HER2 的地位在 PDO111、PDO141 和 PDO118 中得到了很好的保留。然而,尽管在 PDO058 中保留了 PR 和 HER2 的状态,但一定比例的细胞从 ER 阴性变为 ER 阳性。这些结果表明,无论是否接受过药物治疗,早期乳腺癌类器官保留了原肿瘤的组织病理特征,然而延长培养可能会给 PDO 带来一些变化。
对12对乳腺癌类器官(第1-2段)和亲代肿瘤进行WES,以确定来自药物治疗和未治肿瘤的乳腺癌类器官是否保持父母基因组特征。CNAs的全基因组外显子组分析表明,在整个基因组的乳腺癌细胞系中,无论是药物治疗、未治疗及转移肿瘤,亲代肿瘤的DNA拷贝数损失和获得都保留下来(图2A)。在原发肿瘤中发现的CNV基因中,平均有63.8%保存在类器官中。进一步对比类器官和相应乳腺癌中癌症相关基因的CNA谱,与全基因组结果一致的是,乳腺癌类器官在平均66.8%的原始肿瘤中重现了选定的癌症相关基因的CNA模式(图2B)。
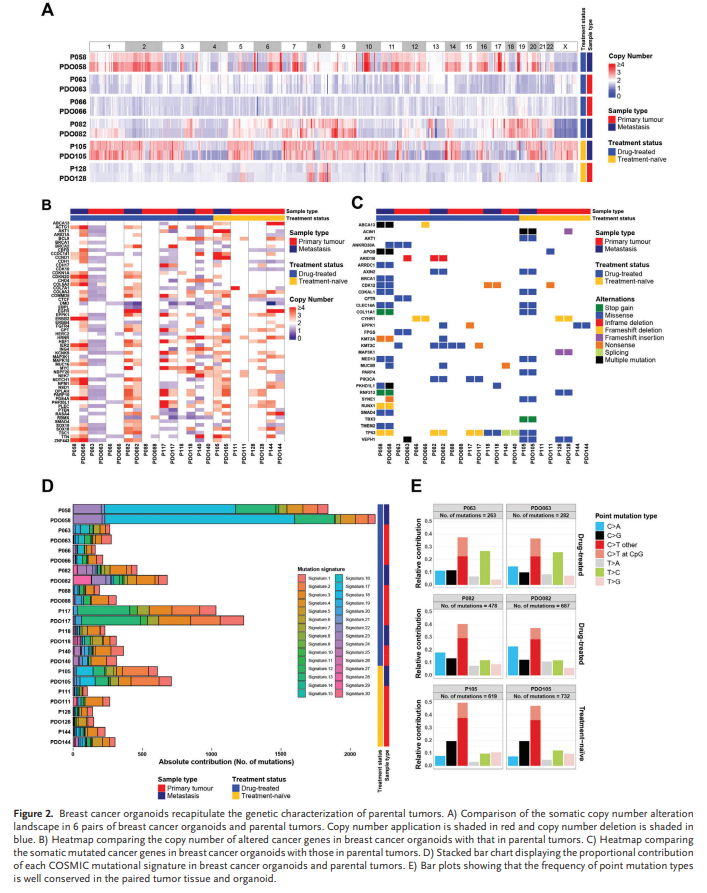
接下来比较亲代肿瘤和类器官中的SNV基因。平均而言,在原发性肿瘤中发现的癌症相关基因中,82.1%保存在类器官(图2C)。值得注意的是,大多数乳腺癌类器官中都保留了与乳腺癌相关的基因突变,如TP53、PIK3CA、CTFR和COL11A1。 在我们的样本中,P058 是一种胸壁转移性乳腺癌,已用多种药物进行大量治疗。重要的是,P058的大部分突变都保存在相应的类器官中。进一步分析了乳腺癌肿瘤和类器官的碱基突变发现,原发性肿瘤的总突变负荷和点突变类型在药物治疗以及未治肿瘤衍生器官器官中都保存良好(图2D、E)。类器官突变特征的相似性为87%(范围从67%到99%)(图2D)。
总之,类器官在一定程度上保留了亲代肿瘤的基因组特征,但它们之间也存在一些差异。与亲代肿瘤相比,类器官中CNA和SNV基因的数量更高。
4、乳腺癌 PDOs 的药敏筛查
在药物筛选策略方面,我们首先希望为每个患者找到批准用于乳腺癌的最敏感药物,我们还尝试从非乳腺癌药物中开发潜在的候选药物,这些候选药物将来可用于乳腺癌治疗。据此药物库中包含 49 种药物,包括 19 种乳腺癌药物和 35 种其他类型的癌症药物。
PDO药物表型在PDO对药物治疗的反应中显示出显著的变异性(图3A,B)。乳腺癌PDOs对甲醛和卡铂持续耐药,但通常对米托蒽酮、表柔比星和阿霉素的治疗敏感。此外我们发现一些非乳腺癌药物,包括托托特坎(拓扑异构酶I抑制剂)和硼替佐米(蛋白酶抑制剂),在大多数器官系中反应良好。
为了进一步评估硼替佐米治疗癌症的潜在毒性和可行性,我们对结肠癌和乳腺正常器官系进行了硼替佐米药敏测试。我们发现,肿瘤类器官对硼替佐米治疗的敏感性高于正常的类器官线,这表明该药物在治疗不同类型癌症方面的潜在应用价值。
值得注意的是,PDOs同时表现出对核酸合成抑制剂(吉西他滨、克拉霉素和阿糖胞苷)和微管抑制剂(多西他赛、紫杉醇、长春瑞滨、伊沙匹隆、长春新碱和长春碱)的敏感性和耐药性。与原发肿瘤相比,从转移性肿瘤中提取的类器官对微管抑制剂和EGFR靶向药物的耐药频率更高。值得注意的是,大多数从转移性肿瘤中提取的器官表现出对帕博西利布(CDK4/6抑制剂)和头孢素(抑制TNF-α介导NF+B刺激)的抵抗力。未发现经治和未治肿瘤之间的药物反应明显不同。其中13种器官系对75%的测试药物具有耐药性,而对不超过3种药物敏感。此外,多种耐药肿瘤衍生的 PDO(如 PDO057、PDO058 和 PDO115)对各种测试药物表现出高频耐药性。

为了确认不同的药物反应,我们分别用DNA合成抑制剂(吉西他滨)或微管抑制剂(紫杉醇)处理耐药性和敏感性器官系。经过24小时处理,我们观察到敏感类器官周围有凋形囊泡,在48h时更明显(图3C、D)。Western blotting分析显示,吉西他滨更有效地降低了激活转录因子(p-STAT3),增加了线粒体检查蛋白(环素B1和环素A),并在敏感器官系中增加促凋亡蛋白(cleaved caspase-3)的表达(图3E)。通过紫杉醇治疗,敏感细胞系中环素A下调、环素B1、p-BCL和凋亡蛋白上调。在图3F中,敏感系 (PDO050 和 PDO073) 的生长速度明显快于耐药细胞系 (PDO023 和 PDO038)。
为了探讨利用PDO平台识别潜在联合药物治疗乳腺癌患者的可行性,我们进一步筛选了3个类器官系上的抗癌药物,并在IC30浓度下与候选药物联合,并确定了检测的器官系的潜在联合疗法(图3G-I),这可能为晚期疾病患者提供更多的药物治疗选择。
5、针对微管靶向药物的PDO药物转录组特征反映了乳腺癌患者的临床治疗结果
在57个乳腺癌器官系上进行了RNA测序,使用六种微管靶向药物评估其转录特征:多西他赛、紫杉醇、长春瑞滨、伊沙巴隆、长春新碱和长春碱。基于基因表达的相应热图显示,对微管靶向药物敏感的细胞系倾向于聚集在一起(图4A)。对微管靶向药物表现出耐药性或中度反应的细胞系分别聚集在一起,异质性更大。这些结果表明,乳腺癌细胞系对微管靶向药物的反应与其转录谱高度相关。
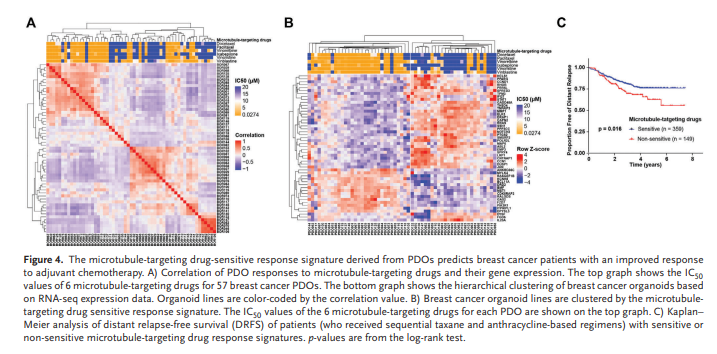
通过使用已识别的特征将PDO分类,PDO 可以分为敏感和非敏感类(图4B)。为了确定 PDO 对微管靶向药物的敏感反应特征是否反映了乳腺癌患者的治疗反应,我们从基因表达综合数据库 [GEO:GSE25066] 中获取 508 名患者的数据,包括 359 个具有药物敏感反应特征的肿瘤数据和 149 个具有相反特征的肿瘤数据。我们发现,具有微管靶向药物敏感反应特征患者远期无复发存活率明显高于耐药组(图4C)。PDO微管靶向药物敏感反应特征与生存结果的高相关性表明,PDO是开发癌症患者新疗法和药物的宝贵平台。
6、PDO药物表型反映了相应患者先前的治疗反应
为确定PDO药效表型是否代表患者先前的药物反应,我们跟踪了35例患者。患者Pat057为3级三阴性乳腺癌(TNBC),并依次接受手术切除和辅助化疗(表阿霉素、环磷酰胺和多克他素)。治疗3个月后,患者复发并出现肝转移,随后便依次接受了四轮额外的治疗如下:长春瑞滨和顺铂、吉西他滨和依维莫司、卡培他滨和贝伐单抗和白蛋白结合型紫杉醇和爱必妥。病人对这些药物治疗均表现出耐药性,病情进展(图5A,B)。在这些治疗结束时,我们从该患者的肝转移组织中提取了类器官(PDO057),并进行药物筛选。我们的药物表型结果显示,PDO057对长春瑞滨有中度反应,对我们的药物面板中所包含的所有其他接受的药物具有耐药性(图5C)。

在我们的研究中也能找到一些不一致的案例。如患者Pat082对脂紫杉醇、卡铂、多西他赛、表柔比星联合治疗出现耐药,而我们的药物表型结果显示,PDO082对紫杉醇、多西他赛、表阿霉素敏感。然而,患者在第三轮(长春瑞滨、顺铂、阿帕替尼)治疗后病情稳定,这与PDO082对长春瑞滨、顺铂的敏感性一致。前两轮治疗的反应与药物表型结果不一致可能是由于缺乏PDO的肿瘤微环境或肿瘤进化所致。总的来说,PDO化疗敏感性与相应患者的回顾性临床数据基本一致。
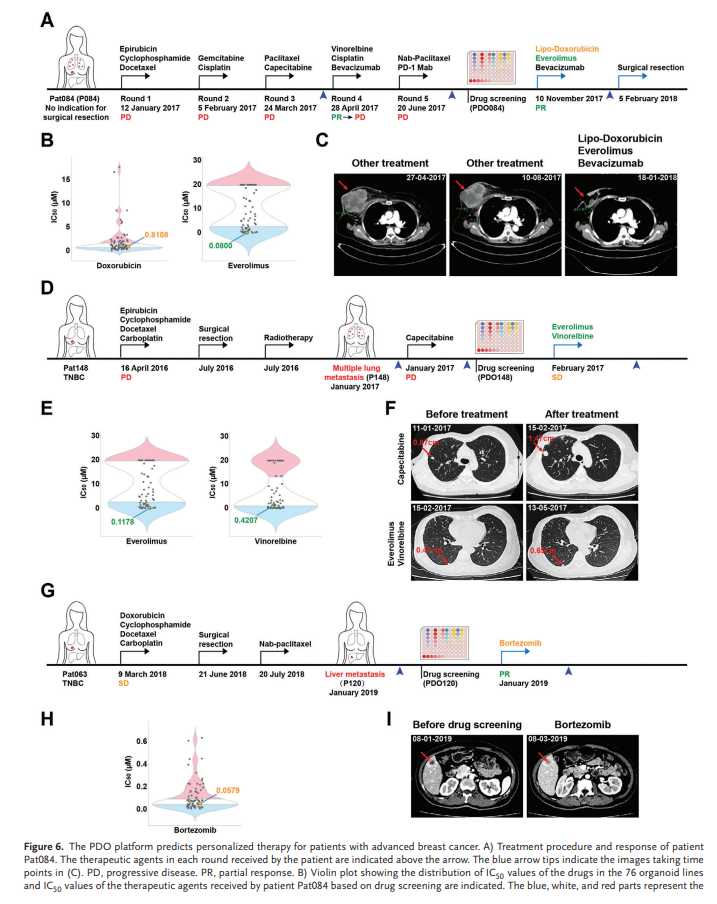
7、PDO药物表型预测个性化治疗的患者特异性敏感性
该平台的主要目标之一是为每个患者提供有效药物。在这里,我们主要关注耐多药性和转移性乳腺癌。患者Pat084在晚期被诊断为大原发性肿瘤(8.9厘米×8.1厘米),双肺多转移,且无手术切除指征。此外,肿瘤(P084)对五轮治疗有抵抗力(图6A)。然后我们生成3D类器官(PDO084)并进行药物筛选,发现阿霉素、依维莫司、表阿霉素是该患者的潜在候选药物。此外,患者参加了商业靶向测序服务,结果显示,她的肿瘤存在PTEN基因突变,导致 PI3K/AKT/mTOR 通路异常激活,提示mTOR可能是该肿瘤的有效治疗靶点之一。根据这些结果和临床实践指南,患者接受了脂类阿霉素、依维莫司和贝伐单抗治疗。值得注意的是,这种联合治疗导致了有效的肿瘤消退,肿瘤体积减少,大多数病变坏死,这使得患者可以进行改良根治术(图6B,C)。
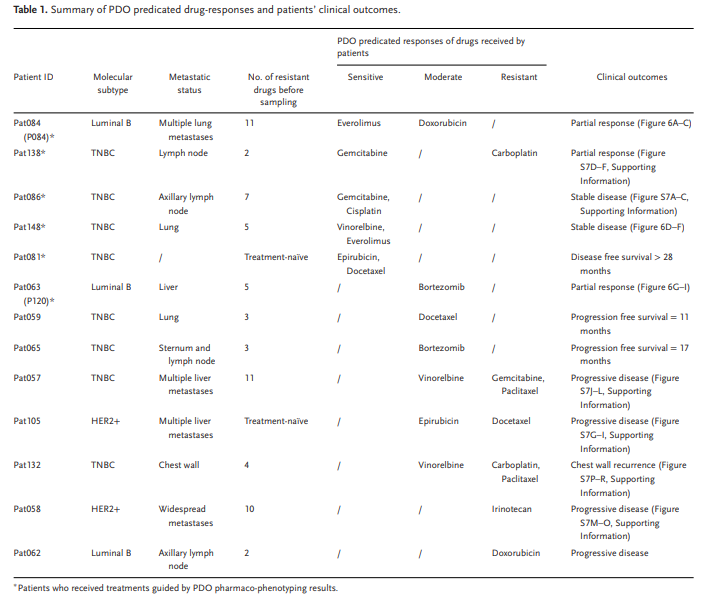
我们完全采用这种方法指导6名患者的治疗,她们都有晚期与TNBC,耐药性,或转移性肿瘤(图6,表1)。受益于这些个性化的治疗,三个病人(Pat063,Pat084和Pat138)实现了部分响应,两个病人(Pat086和Pat148)实现了病情稳定,一个病人(Pat081)无病生存直到现在。我们跟进了另外七例病人,根据我们的数据,100% 的治疗 (5/5), 其中包括至少一种药物, 前提是 PDOs 敏感, 实现了部分反应, 稳定的疾病, 或长期无病生存。在接受至少一种药物,预计PDOs反应适中的患者中,50%(3/6)的患者疾病进展,一名患者获得部分反应,另外两名患者在手术切除肿瘤后分别实现了11个月和17个月的无进展存活。对于其余两种治疗方法(Pat058 和 Pat062),不包括任何基于 PDO 敏感或反应适中的药物,并且两个患者肿瘤进展。总体而言,基于药物敏感测试,所有13名患者都表现出可预测的反应。因此PDOs可作为一个诊断平台,以支持和指导药物治疗晚期乳腺癌。
总之,我们已经从肿瘤组织中生成了一个乳腺癌类器官生物库,该生物库涵盖了乳腺癌的治疗状态、疾病分期和分子亚型信息,成功率高。我们发现,PDOs,即使是在大量治疗的乳腺癌中形成的,也能在一定程度上保留原发肿瘤的组织学和遗传特征。我们进一步证明原发性肿瘤的治疗反应在其PDO系中也得到了很好的保留。更重要的是,我们开发了PDO模型作为一个实时平台来指导晚期乳腺癌的临床药物治疗。我们的研究表明,PDOs不仅可以作为更广泛的癌症研究的临床前模型,而且可以为晚期疾病患者提供个性化的治疗建议。
原文来源:
Yanxia Shi,*Ying Lin,* and Chuxia Deng*,Patient-Derived Organoids Can Guide Personalized-Therapies for Patients with Advanced Breast Cancer.Adv. Sci. 2021, 2101176.


