赛诺菲度普利尤单抗治疗儿童湿疹适应症国内NMPA获准;全球销售达60亿美元
时间:2022-03-07 10:10:52 热度:37.1℃ 作者:网络
Dupixent全球
Dupixent(Dupilumab注射液)由再生元(Regeneron)和赛诺菲开发的一款全人单克隆抗体,其针对IL-4Rα上同时结合IL-4及IL-13的亚基,因此能够同时阻断IL-4及IL-13的信号传导。
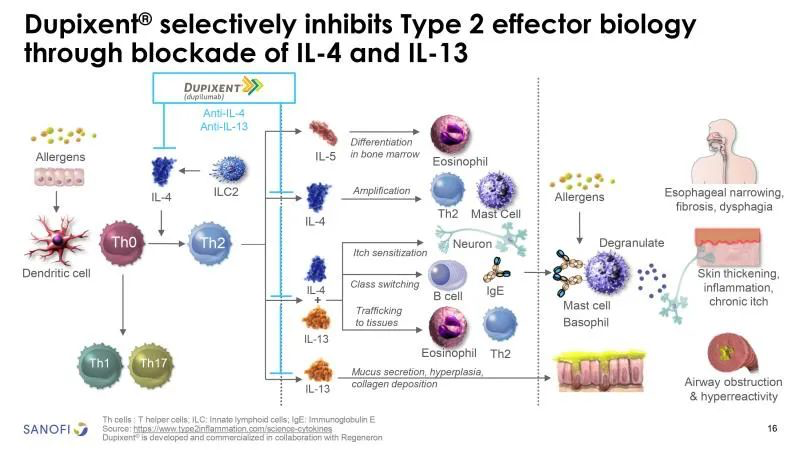
2017 年 3 月 28 日, 获美国 FDA 批准上市,成为首个治疗中重度特应性皮炎的生物制剂。目前获批的适应症有:中重度特应性皮炎(AD)、哮喘、慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)、6-11岁儿童中重度哮喘、6-11岁儿童中重度特应性皮炎等等。
赛诺菲年报/季报显示,Dupixent(Dupilumab注射液)2018年销售收入达7.88亿欧元;2019年达20.74欧元(约合22.49亿美元),同比增长152%。2020年全球销量为35.34亿欧元。2021年全球销售额达52.49亿欧元;同比增长48.53%。
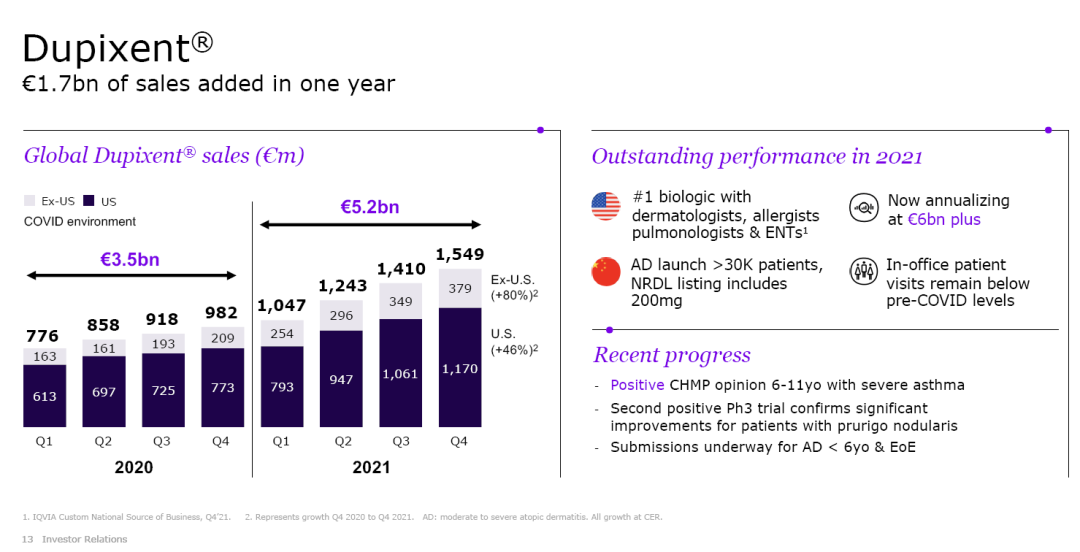

▲赛诺菲(上图)和再生元(下图)统计业绩稍微有出入,可能因权益合作及汇率等因素导致
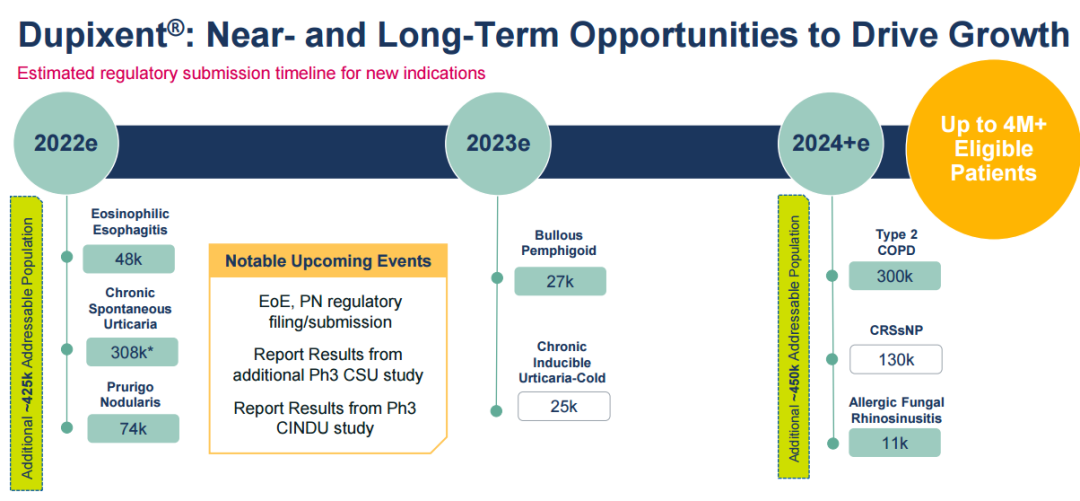
再生元/赛诺菲对Dupixent(Dupilumab注射液)寄予厚望,预计销售峰值将有望突破100亿欧元,成为超级重磅炸弹,基于多项关键后期临床积极进行中(结节性痒疹、嗜酸性粒细胞性食管炎等)。
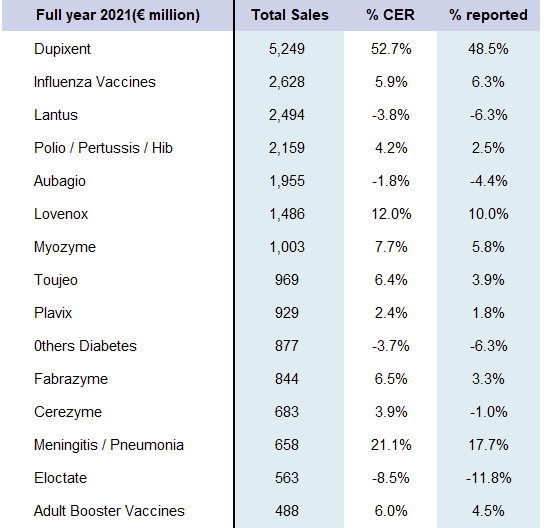
▲赛诺菲2021财年主要产品业绩
Dupixent中国2020年6月在Dupixent(Dupilumab注射液,度普利尤单抗)成人中重度特应性皮炎适应症中国获批,注册证号:S20200017。2020年12月底,经国家医保谈判,被正式列入《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》,是新版医保目录中唯一一个治疗中重度特应性皮炎的靶向生物制剂,用于对传统治疗无效、有禁忌或不耐受的中重度特应性皮炎。上市仅5个月即被纳入国家医保目录,这个风向标值得国内药企关注;公司将大幅降价。
2021年9月,度普利尤单抗注射液在中国获批用于治疗外用药控制不佳或不建议使用外用药的12岁及以上青少年和成人中重度特应性皮炎。
2022年2月,度普利尤单抗注射液获得中国国家药品监督管理局(NMPA)批准,拓展用于治疗外用药控制不佳或不建议使用外用药的6岁及以上儿童和成人中重度特应性皮炎。此次儿童新适应症的获批,基于一项关键性全球儿童3期临床试验,以及中国成人及青少年中重度特应性皮炎适应症的数据外推。这是一项随机、双盲、安慰剂对照研究,评估了达必妥®联合局部外用皮质类固醇(TCS)治疗儿童重度特应性皮炎的疗效和安全性。试验中,接受达必妥®和TCS联合治疗的儿童患者总体疾病严重程度、皮肤清除率和瘙痒较TCS单药组都得到了显著改善。数据显示,达必妥®和TCS联合治疗组中皮损得到清除或几乎清除的患者人数达到TCS单药组的两倍多,瘙痒程度显著缓解的患者人数是TCS单药组的四倍多,疾病总体改善程度至少达75%的患者人数近四分之三,平均改善程度达到约80%。
▲药品信息:
通用名:度普利尤单抗注射液
商品名:达必妥
规格:300mg(2.0ml)*2支/盒
药融圈显示,医保谈判前价格13332元;谈判后价格为元6320元/盒


