Brugada综合征:传统认识与证据的更新
时间:2021-12-13 14:01:49 热度:37.1℃ 作者:网络
Brugada综合征(Brugada syndrome, BrS)是与离子通道基因突变相关的一种遗传性心脏离子通道病,主要表现为心电图右胸(V1-V3)导联J点抬高 伴ST段穹窿样抬高,临床上其特征是在可能发生多形性室速和室颤,引起晕厥,甚至心脏性猝死(sudden cardiac death,SCD)。
BrS的全球总发病率约为0.05% ,以东南亚发病率最高(1/1000-2000),欧美相对较低(1/5000-10000),健康青年男性多见。
Brugada兄弟于1992年最早报道了8例心电图表现为右束支阻滞图形伴ST段抬高的患者反复发生晕厥和猝死的报告;1996年由严干新教授等率先引入了BrS这一概念,随后于2002年以及2004年分别制定了BrS的两个国际专家共识。

2015年美国心脏节律协会(HRS)、欧洲心脏学会(EHRA)和亚太心律协会(APHRS)的18位来自美国等多个国家的相关专家在中国上海制定了J波综合征(包括BrS和早复极综合征)的上海共识,至今用于指导J波综合征的研究及临床诊治,处于核心的地位。
2020年9月29日由中国心电学会遗传心律失常心电图工作委员会举办的遗传性心律失常专题讨论会就BrS的病因(发病机制和遗传学)、诊断(诊断标准、鉴别诊断)、危险分层以及治疗等同时结合两个临床病例进行了系统的阐述、讲解和讨论,本文予以总结,希望能增进临床工作者对BrS的进一步了解并予以重视和关注。
1. BrS的发病原因
1.1 遗传学
上海共识明确了18个与BrS相关的基因,分别是SCN5A,SCN10A,SCN1B,SCN2B,SCN3B,GPD1L,RANGRF,SLMAP,KCNE3,KCNJ8,KCNE5,KCND3,HCN4,CACNA1C,CACNB2B,CACNA2D1,TRPM4和PKP2的变异,多为钠、钾、钙离子通道相关基因的变异。其中SCN5A基因的变异最常见,检出率约为18%-28%,是中国指南唯一推荐检测的BrS相关基因,但这个基因的假阳性率为3%-5%。
上海共识认为:应以概率论来解读基因结果在诊断BrS的作用,不能单纯根据基因检测结果进行诊断或排除诊断,基因结果应结合临床资料作为支持诊断的证据。
1.2. BrS发病的电生理学机制
发病机制尚未完全阐明,目前较认可的三种假说包括:复极化假说、去极化假说和神经嵴假说。这三种理论在BrS的发生中并非独立存在,也可能通过相互协同而发挥作用。
1.2.1 复极化假说
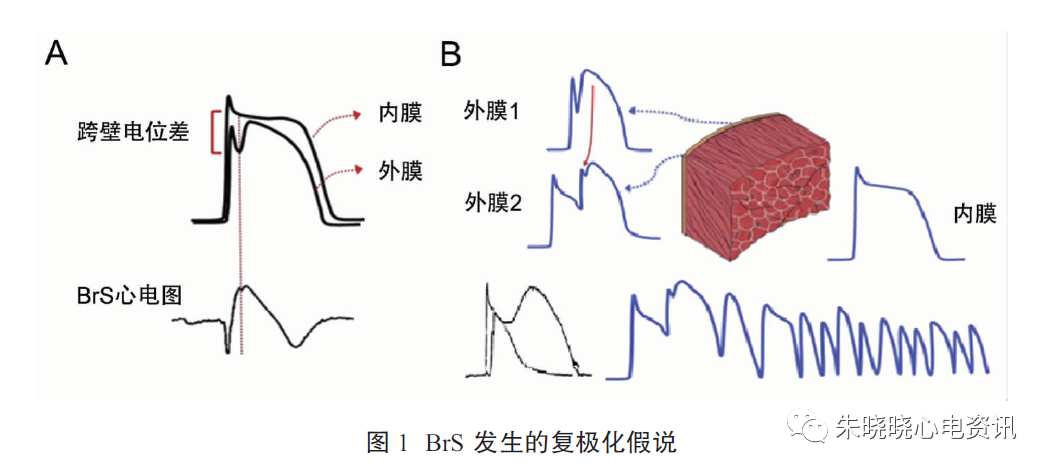
复极化假说认为BrS的形成与内向钠、钙电流以及外向钾电流异常有关。产生Ito的钾通道在右心室流出道外膜区域分布较内膜多,故心外膜1相有明显的尖峰(动作电位1相)和尖峰后切迹(图1-A)内、外膜间的尖峰电位差是心电图J波形成的原因。
在正常心脏,J波幅度小或与QRS波融合,但当动作电位0期Na+内流减少时(如SCN5A基因突变或使用钠通道阻滞剂),造成峰电位幅度降低,或Ca2+内流减少导致2相幅度降低时,Ito相对增大,内、外膜电位差更明显,因此1相膜电位迅速下降,形成明显切迹,2相圆顶波下移,穹窿变小;心电图上J波也更突出。
如若峰电位进一步被抑制,Ito相对更大,Ca2+内流明显减少乃至完全不能内流,至平台期完全消失,膜电位提前复极,APD缩短,复极的透壁离散度明显增加。
心外膜细胞2相圆顶波不均一丢失,处于圆顶期的外膜细胞与丢失圆顶期的外膜细胞之间存在电位梯度,电流从前者流向后者,发生2相折返,使后者再次除极,出现R-on-T的室性早搏,引发室速/室颤(图1-B) 。
1.2.2 去极化假说
除极化假说认为右室流出道(RVOT)处的传导延缓是BrS发生的重要原因。Nademanee等15发现BrS患者在RVOT外膜由于传导延迟心电图可观察到晚电位和碎裂双电位,对该处射频消融后,患者VT/VF易感性降低,且心电图恢复正常。
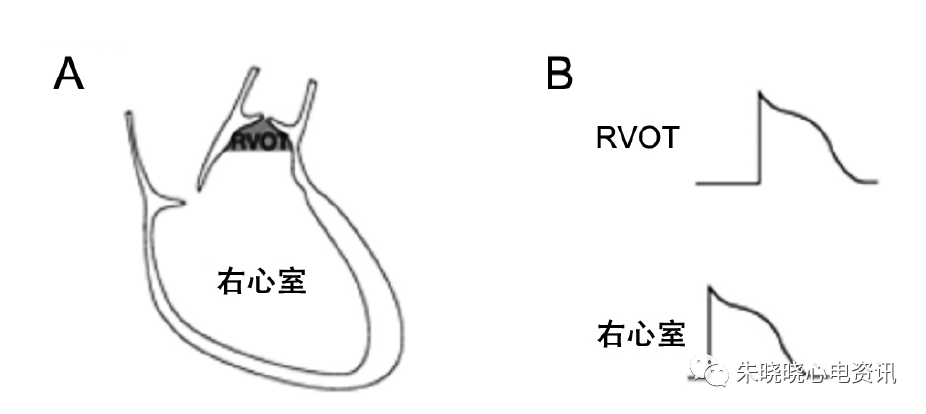
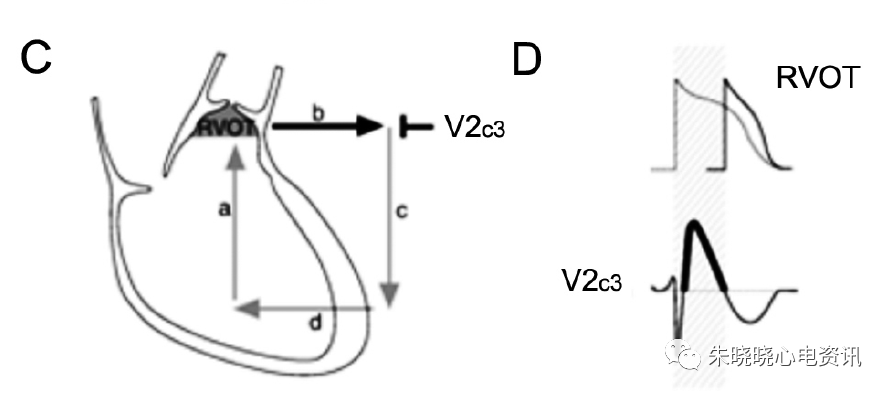
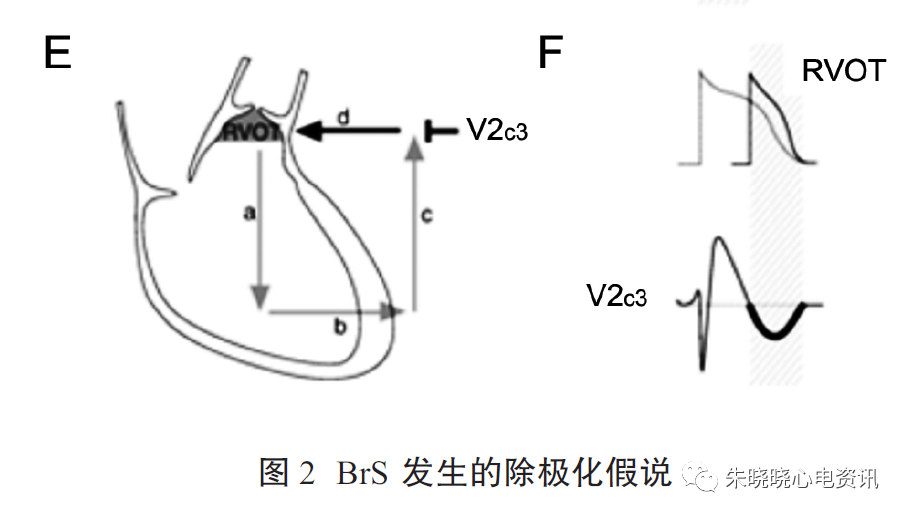
由于RVOT处兴奋传导减慢引起的延迟除极(图2-A,2-B),使RVOT与右心室之间存在电位差,使得兴奋由右心室传至RVOT,再回到右心室,构成传导的闭环(图2-C)。此时对应RVOT体表投影的V1-V3导联则出现ST段上抬(图2-D)。
在下一个心动周期,RVOT电位高于右心室,闭环传导方向反转(图2-E),则ECG出现T波倒置(图2-F)。RVOT部位的兴奋传导减慢可能与SCN5A基因突变、Cx43的减少和心肌纤维化有关。
1.2.3 神经嵴细胞假说
这个假说整合了去极化和复极化假说,认为RVOT及其周围组织与心脏其他部位胚胎来源不同,故而电生理、解剖特性也有所不同。BrS的发生是由于胚胎发育中RVOT及其附近组织神经嵴细胞异常表达,导致了缝隙连接蛋白,尤其是Cx43的异常表达,使得心肌复极不均一,且合并RVOT部位传导延缓,最终导致ECG改变和恶性心律失常。
在讨论环节中,严干新教授指出复极异常是主要机制,下列证据不支持除极假说:奎尼丁治疗有效是阻断Ito电流,而其他的Ⅰ类药物如氟卡尼、普罗帕酮却诱发BrS波;RVOT区域射频消融治疗BrS不能作为除极化假说的支持证据,只能说明BrS病变局限在RVOT处。2型和3型BrS相当于是在其他导联上的J波抬高和ST段抬高,类似于传统意义上的早复极综合征,危险性不高。在下壁导联上可罕见1型BrS波,在慢频率下可出现,频率快时又消失,呈动态变化。严教授认为Brs和早复极综合征机理相通。用病例证实奎尼丁虽然是钠通道阻滞剂,但能阻断Ito电流是强有力的治疗药物。
3、BrS的诊断
3.1 诊断标准
上海共识7更新了BrS的诊断标准,即:
(1)在第2、3或第4肋间的右胸导联(V1-V2)6个位置中,有≥1个导联观察到自发性1型Brugada心电图(J点抬高≥2mm伴ST段穹隆样抬高)即可确定诊断;
(2)若由钠通道阻滞剂、发热或饱餐激发出的1型Brugada心电图,需同时具备以下至少一项表现方可诊断为BrS:
①有VF或多形性室速的证据;
②晕厥很可能由心律失常引起;
③<45岁的家族成员中发生SCD且尸检阴性;
④家族成员表现为穹窿型ECG改变,或夜间濒死呼吸。如果上述患者由电生理检查中给予1-2个期前收缩可诱发出VT/VF,则更支持BrS的诊断。
(3)对2型(马鞍型)或3型ST段抬高者,若经发热或钠通道阻滞剂激发后转变为1型Brugada心电图可认为是1型改变,但诱发1型改变的患者心律失常发作的危险性低,如果诊断为BrS可能造成过度诊断。此次共识还给出了Brs诊断的评分标准(如表1):总分≥3.5时可确诊或极可能为BrS;2-3分为可能BrS;<2分无诊断意义,并建议这些标准中必须包含一项ECG改变。

3.2 临床表现
3.3 辅助检查
3.3.1 心电图检查

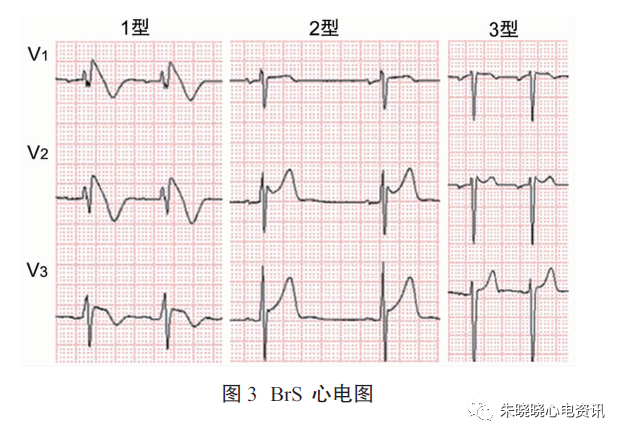
BrS的的诊断主要依据心电图,Brugada的心电图表现可分为以下三种(图3):
1型:J点及ST段抬高>2mm,呈“穹隆”形改变,T波倒置,ST段与T波之间无等电位线;
2型:J波抬高幅度>2mm,ST段下斜型抬高,T波正向或双向,ST-T改变呈“马鞍”型;
3型:ST段抬高<2mm,呈“穹隆”型或“马鞍”型。
其中只有1型改变可诊断BrS,其他类型可诊断Brugada心电图或Brugada波。
3.3.2、药物激发试验
对临床上心电图为2型或3型Brugada改变者,或有BrS/SCD家族史的无症状患者可以在密切监护下进行钠通道阻滞剂激发试验。
常用的激发试验药物见表2,其他药物可在网站www.brugadadrugs.org查询。给予药物后出现典型1型心电图变化即为阳性。
需要指出的是:经药物诱发性1型改变过去认为和诊断BrS,上海共识认为这类患者危险性低,按传统标准造成假阳性率高和对BrS的过度诊断 。儿童期进行阿义马林激发试验敏感性低、风险高,应谨慎选用。“饱餐试验”作为替代方案,可对比大量进食前后的ECG变化。

4、鉴别诊断
Brugada的心电图表现可出现在其它多种疾病,称为Brugada拟表型(Brugada phenocopy),指临床上因其他诱因或病因而出现典型的Brugada样ECG,且去除病因后心电图可恢复正常,无BrS相关症状以及SCD家族史,钠通道阻滞剂激发试验阴性,基因检测结果阴性(非必需)。
4.1、BrS拟表型的诱因/病因 (表3)
(1)代谢相关因素,如电解质紊乱(低/高钾血症、低钠血症和高钙血症)、高热或低体温等;
(2)肺栓塞;
(3)机械挤压如漏斗胸、胸壁震荡综合征等,与RVOT损伤有关;
(4)心肌与心包疾病,如心肌损害、心肌淀粉样变性、急性心包炎等;
(5)迷走神经张力异常。夜间迷走神经张力增高及心动过缓可加剧心电图改变。

4.2、获得性Brugada心电图
发热以及药物诱发的Brugada样ECG因发生机制、临床意义及预后和Brugada拟表型不同,称为获得性Brugada心电图。发热可使隐匿患者心电图出现1型改变,推测与SCNA5基因变异对温度敏感的异质性有关。此外药物、可卡因、酒精摄入等均可导致心电图改变更加明显,亦有可能导致恶性心律失常,但风险性较低。
4.3、ARVC
AVRC是一种遗传性心肌病,因编码心肌桥粒蛋白的基因突变,导致心肌细胞被纤维或脂肪组织替代,导致室性心律失常甚至SCD,可合并右心室扩大和心力衰竭,与BrS有类似之处。
两者的鉴别点有:
1、主要致病基因不同;
2、ARVC影像学显示明显的右心室结构异常,而BrS表现为正常或轻度异常;
3、心电图上ARCV右胸导联QRS波延长,出现epsilon波,T波倒置,而BrS则为类RBBB波形,右胸 ST段起点抬高和T波倒置;
4、ARVC相关的室性心律失常由瘢痕相关折返导致,为单形性类左束支阻滞型VT/VF,但BrS诱发的室性心律失常则由2相折返导致,为多形性VT/VF;
5、ARVC可出现心悸,晚期可发展为心衰。
4.4、早复极综合征(early repolarization syndrome,ERS)
BrS和ERS同属J波综合征,两者具有很多相似之处:均多见于青壮年男性;致病基因突变相似;心电图呈动态改变;多于睡眠或低强度体力活动时发作VF;低体温或迷走神经张力增加可加剧ECG改变;许多药物(如奎尼丁、异丙肾、西诺他唑)等都有改善效应。但二者也有明显的不同点,表现为:
(1)心脏受累部位不同:ERS 的显著J 波出现在侧壁(1 型)、下侧壁(2 型)或下侧壁+ 前壁或右胸导联(3 型);
(2)ERS患者心脏结构一般正常;
(3)发病率的地域差异性,在欧洲,两者发病率近似或相等;而在亚洲,BrS的发病率高于ERS;
(4)BrS的晚电位和房颤的发生率高于ERS。钠通道阻滞剂主要影响BrS的复极和ERS的除极,应用钠通道阻滞剂后BrS患者J波幅度增加,,而ERS患者的J波幅度降低,考虑与QRS的时限延长相关。
5、危险分层
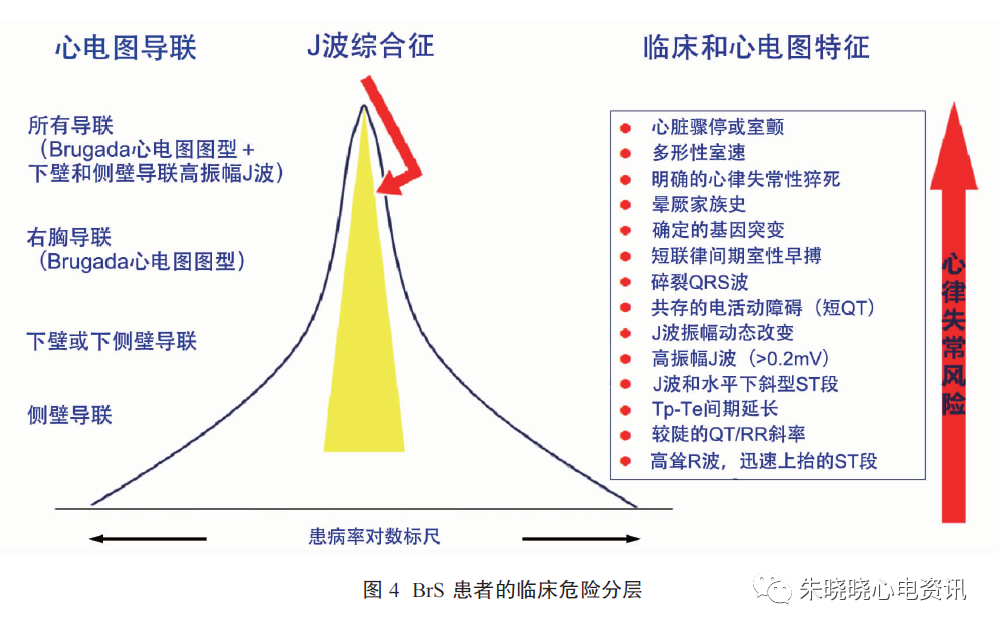
对Brugada心电图表型的患者进行危险分层有助于筛选高危人群,从而选择合适的治疗方案(图4)。
5.1、临床表现
临床表现预测BrS患者危险性的价值最高。
(1)心脏骤停:有心脏骤停史的患者再发VF的风险大:分别为≈35%/4年,44%/7年,48%/10年;
(2)晕厥:曾出现晕厥的患者,风险中等:较无症状患者高4倍,但较有心脏骤停史的患者低4倍31;
(3)无症状:这些患者以后发生症状的危险性较低,约为0.5%/年。
5.2、年龄和性别
BrS患者心脏骤停发生的平均年龄为39-48岁,儿童少见,老年患者多无症状,预后较好。BrS患者发生心脏骤停者中男性占64%-94%,男性出现自发性I型Brugada心电图或EP检查中VF的诱发率均高于女性。由于大多数无症状BrS患者为男性,性别不是心律失常发生的独立预测因子。
5.3、自发性与药物诱导性1型BrS患者对比
自发性1型ECG改变是心律失常事件的独立危险因素,心律失常事件发生的风险高于钠通道阻滞剂诱发的1型BrS。反复检查ECG发现,多数患者不存在心电图的持续改变,因此应慎重对待单次ECG检查在危险分层中的意义。
5.4、基因型与家族史
SCD家族史以及SCN5A基因突变都不是预后的预测因素,但对于临床诊断有支持作用。
5.5、电生理检查及程序心室刺激
对预后评估的价值存在较大争议。虽然VF的诱发率在既往心脏骤停存活者中最高,晕厥患者中等,无症状患者最低,但多数学者认为VF诱发率高低对预后的预测价值有限。应用的期前刺激方案、刺激部位和期前刺激的数目可能影响预测价值。
5.6、ECG指标
与BrS患者的危险程度相关的指标包括: (1)碎裂QRS波; (2)同时出现1型Brugada波和下侧壁导联ERS; (3)显著的J波或ST段抬高且具有动态改变。 与BrS风险相关但证据有限或结论不一致的指标包括: (1)信号平均ECG记录到的晚电位; (2)微小的T波电交替; (3)钠通道阻滞剂激发试验中出现的微小T波电交替; (4)QRS波时限增宽; (5)aVR导联显著的R波; (6)运动试验停止后ECG中1型Brugada波的ST段抬高幅度增大; (7)Tpeak-Tend间期延长和QT/RR曲线斜率变得陡直。
6、治疗
6.1、患者教育与生活方式调整
在日常生活中尽量避免可能诱发恶性心律失常的因素,如迷走神经张力增高、特定药物、酒精和可卡因摄入等。发热时应积极使用退烧药物并密切监测心电图变化。BrS的ECG改变在运动后即刻有加重的现象,推测与迷走神经张力增高有关。
6.2、植入型心脏复律除颤器(ICD)
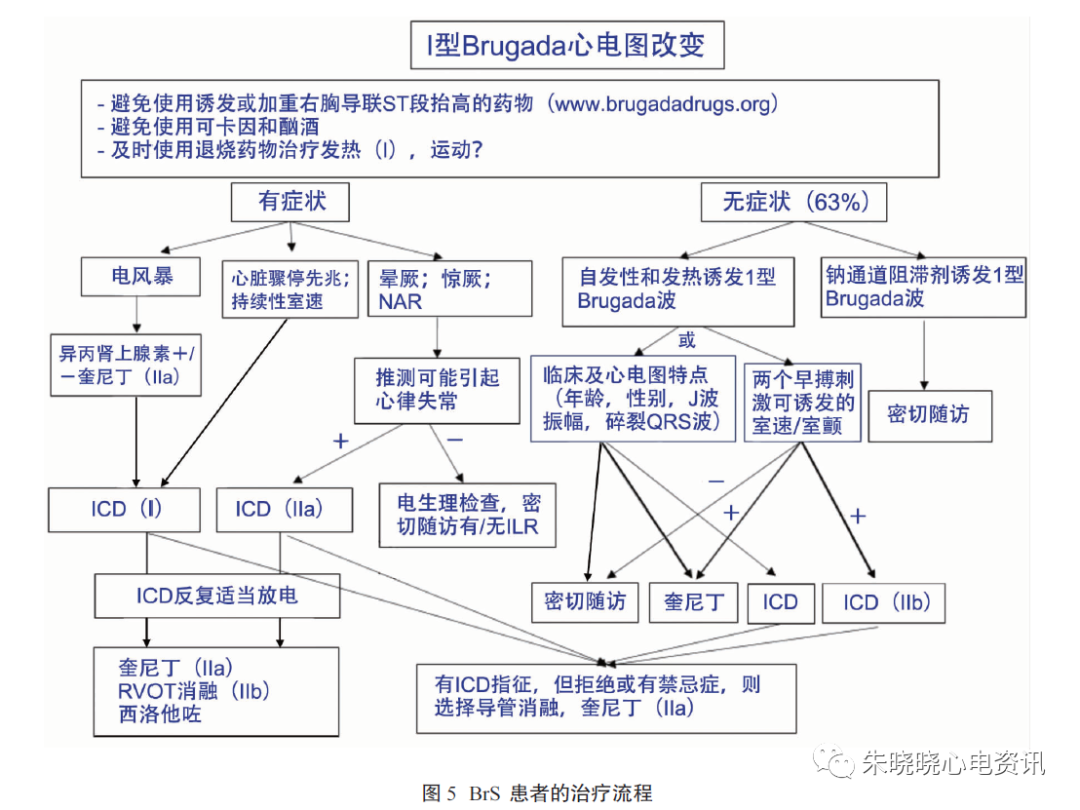
对高危患者,ICD是唯一被证明可有效预防SCD的治疗措施。既往有SCD病史或心电图VT/VF的证据,不论伴或不伴晕厥,ICD植入为I类推荐。
BrS患者有症状且记录到I型ECG改变时,晕厥可能由VT/VF引起,植入ICD是IIa类推荐;BrS患者无症状但在心脏程序电刺激(PES)可诱发出VF时,植入ICD是IIb类推荐。
对无症状的自发性I型BrS患者实施EP检查,如可诱发出VT/VF,应予ICD治疗。但不建议在没有上述特征的无症状患者植入ICD 。
6.3、起搏器治疗
BrS患者的心律失常事件和SCD常发生于睡眠或休息时,与心率减慢相关,目前还没有充分的证据证实起搏治疗有作用。
6.4、射频消融(RFCA)治疗
对BrS患者RVOT外膜记录到的晚电位和双极电图记录到碎裂电位进行RFCA后,心律失常的易感性显著降低、ECG表现得到改善、VT/VF不能再被诱发,大多数患者的Brugada综合征ECG改变在数周或数月内恢复正常。
长期随访(20个月)中少数需要继续药物治疗,VT/VF无复发;对其他措施不能控制心律失常或者不能安装ICD的患者可考虑RFCA;反复发作电风暴而引起ICD频繁放电的BrS患者,也建议RFCA治疗。不适合安装ICD或者ICD植入后反复放电的患者,奎尼丁和RFCA是I级推荐。
6.5、药物治疗
(1)、奎尼丁能可显著抑制Ito 是一种,治疗有效的药物,使ST段恢复正常并预防2相折返和多形性VT的发生,对PES诱发VF的有效预防率为76%到90%。电风暴或植入ICD后反复适当放电时,应考虑使用奎尼丁。对无症状的自发性I型ECG改变,有ICD适应证,但拒绝或有ICD植入禁忌的BrS患者也可使用奎尼丁(Ⅱa类推荐)。推荐剂量为600-900 mg 。 (2)、增加L型钙电流的药物,如β-肾上腺素激动剂(如异丙肾上腺素、地诺帕明、间羟异丙肾上腺素)治疗有效。合并电风暴时,异丙肾上腺素是治疗的Ⅱa类推荐。异丙肾上腺素与奎尼丁合用可有效控制VF风暴并使抬高的ST段恢复正常。 (3)、磷酸二酯酶Ⅲ抑制剂西洛他唑可通过增加cAMP和心率增加钙电流(ICa)、减小Ito,纠正ST段的抬高,起到预防VF的作用。实验模型研究证实,米力农比西洛他唑更能抑制ST段抬高及心律失常,但还没有临床应用的报告。 (4)、稳心颗粒是一种中药,可抑制Ito,在动物模型中与低浓度奎尼丁联合应用可抑制多形性VT发作。 (5)、其他可增加峰钠及晚钠电流的药物,如苄普地尔,也可能有治疗作用。
7、病例分享
浙江大学医学院附属二院心内科潘小宏教授分享了《Brugada综合征合并右束支阻滞:危险性增高》案例。患者于2015年无诱因反复晕厥,意识丧失。
心电图表现为窦性心律,记录到I型Brugada波合并CRBBB图形(图6-A), ICD植入后仍反复发作电风暴。后给予奎尼丁(100mg,每日3次)口服治疗后10个月无发作;停用奎尼丁后再次反复发作多形性室性心动过速电风暴触发ICD放电(图6-B),再次服用相同剂量奎尼丁后随访1年余无心律失常发作(图6-C)。
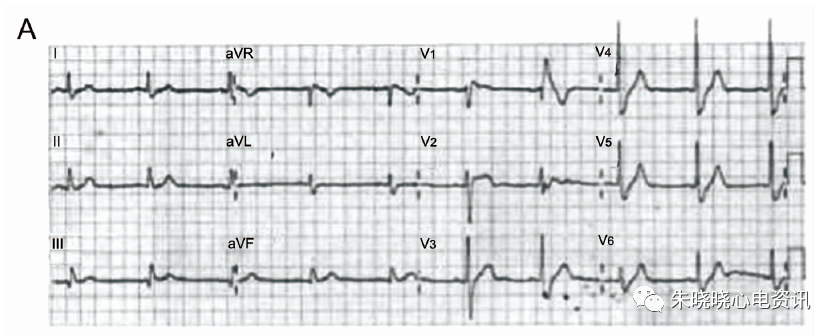
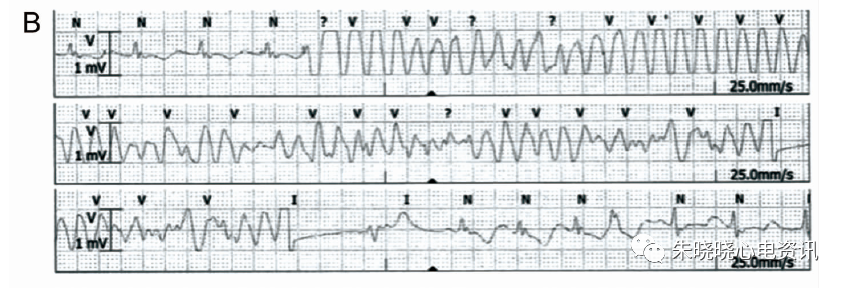
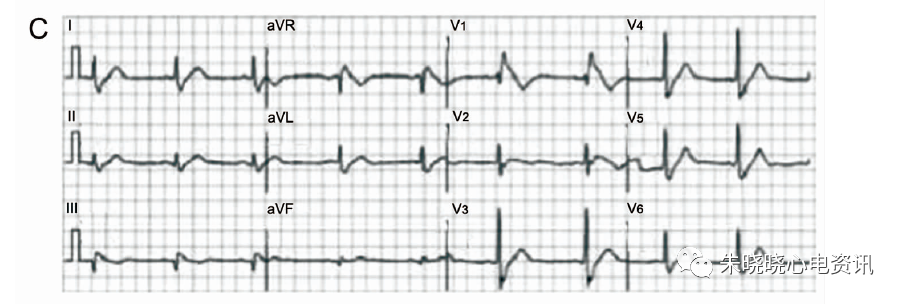
图6 A:患者入院ECG,为1型BrS伴CRBBB;B:患者停药后再发多型性室性心动过速;C:患者再次服用奎尼丁一年后随访静息状态ECG
该病例提示:
1、BrS合并CRBBB少见且容易漏诊,BrS心电图可被CRBBB掩盖,且发生室性心律失常可能性较大;
2、ICD能终止BrS患者VT/VF发作;
3、若患者安装ICD后反复发作ICD放电、电风暴,可考虑低剂量奎尼丁治疗,对预防BrS患者室性心律失常有效。
深圳市人民医院心内科梁新剑教授分享了《一例Brugada综合征介入治疗的案例》,该患者是一名30岁的男性,因心悸气促就医,20岁时曾有1次晕厥,家族有猝死史(具体不详),有典型的BrS样心电图改变,伴阵发性房扑、房颤合并室内差异性传导。
对该患者行心房扑动消融术后植入ICD,在射频消融术中可见RVOT有低电压区并进行基质消融。基因检测提示该患者在SCN5A基因上存在一个已知的与Brugada综合征相关的致病性变异。该患者射频消融术后采用倍他乐克常规治疗,后期经过近3年的临床随访预后良好。
通过基因检测,患者的临床表型与基因检测的疾病比较吻合,这为患者的临床诊断与治疗也提供了重要的参考。
综上两病例患者基于当时条件限制没有行心脏核磁共振检查,与会专家建议由于此类患者Brugada综合征和致心律失常右室心肌病都是右胸导联心电图异常,在条件允许下最好能行心脏核磁共振检查,观察心肌结构变化对鉴别诊断提供有利帮助。BrS在遗传特征和危险性评估上与其他类型遗传心律失常不同,散发和诱发的Brugada心电图患者危险性低。
在第一个病例,讨论了低剂量奎尼丁的治疗效果,ICD后反复电风暴及服用奎尼丁治疗后电风暴消失,提示低剂量奎尼丁治疗需要进一步研;第二例合并复杂房性心律失常,在消融治疗房性心律失常基础上,RVOT的基质消融对预防复发的可行性和有效性需要进一步考虑。
以上说明在目前的治疗中奎尼丁,ICD,射频消融等治疗在Brs治疗中的重要作用。


