辉瑞PF-06882961片临床试验申请获批
时间:2021-03-18 10:01:09 热度:37.1℃ 作者:网络
3月17日,CDE官网显示,辉瑞PF-06882961片(danuglipron)临床试验申请已获默认许可,拟开展治疗2型糖尿病的临床研究。

danuglipron(代号:PF-06882961片)是辉瑞开发的一款口服小分子GLP-1受体激动剂。该款小分子药物有别于注射用和口服用肽类GLP-1RA,能够为糖尿病和肥胖症患者提供一款差异化的创新疗法。
danuglipron的潜在优点包括:①能够实现血糖和体重的有效控制;②耐受性、安全性与肽类GLP-1RA相似,且口服剂型方便服用;③良好的生物利用度;④不同于口服大分子GLP-1RA,不受食物或剂量限制。⑤可开发用于单药或联合用药。

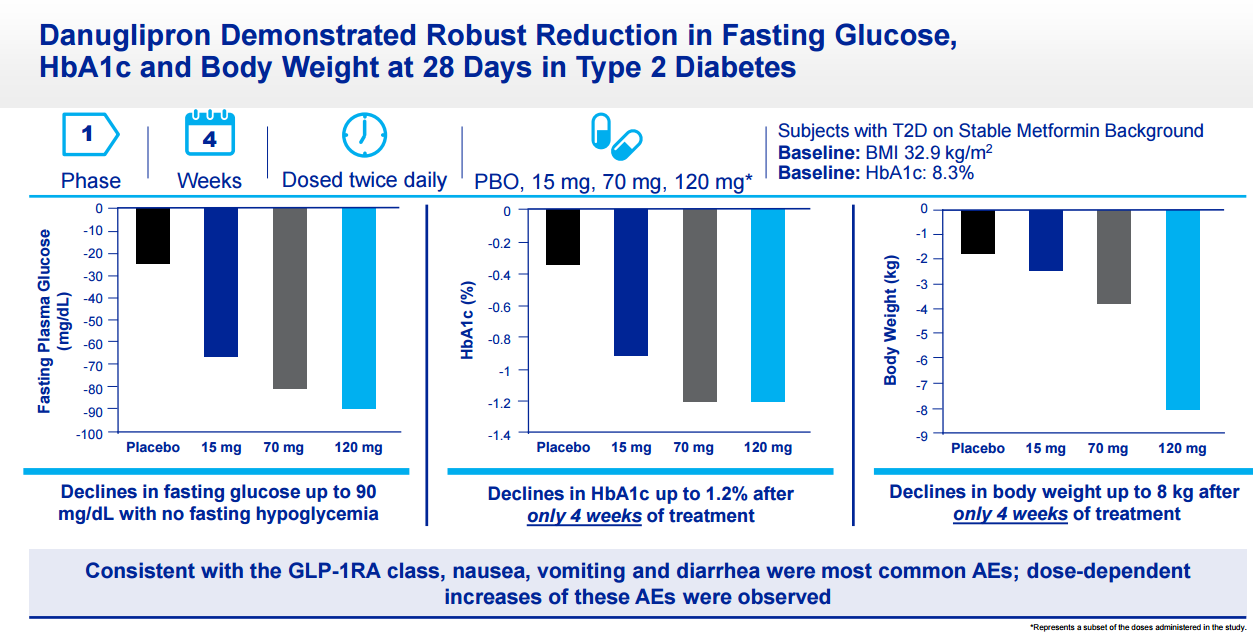
辉瑞在2020年8月举办的线上投资者日活动(Investor Day)会上公布了
danuglipron I期临床研究数据。2型糖尿病患者随机接受安慰剂、danuglipron 15 mg, 70 mg,120 mg,每日2次治疗。在服药28天后,患者空腹血糖水平,糖化血红蛋白(HbA1c)水平和体重都有显著的下降。其中 danuglipron 120mg剂量组空腹血糖下降高达90 mg/dL,HbA1c下降1.2%,体重减轻8kg。
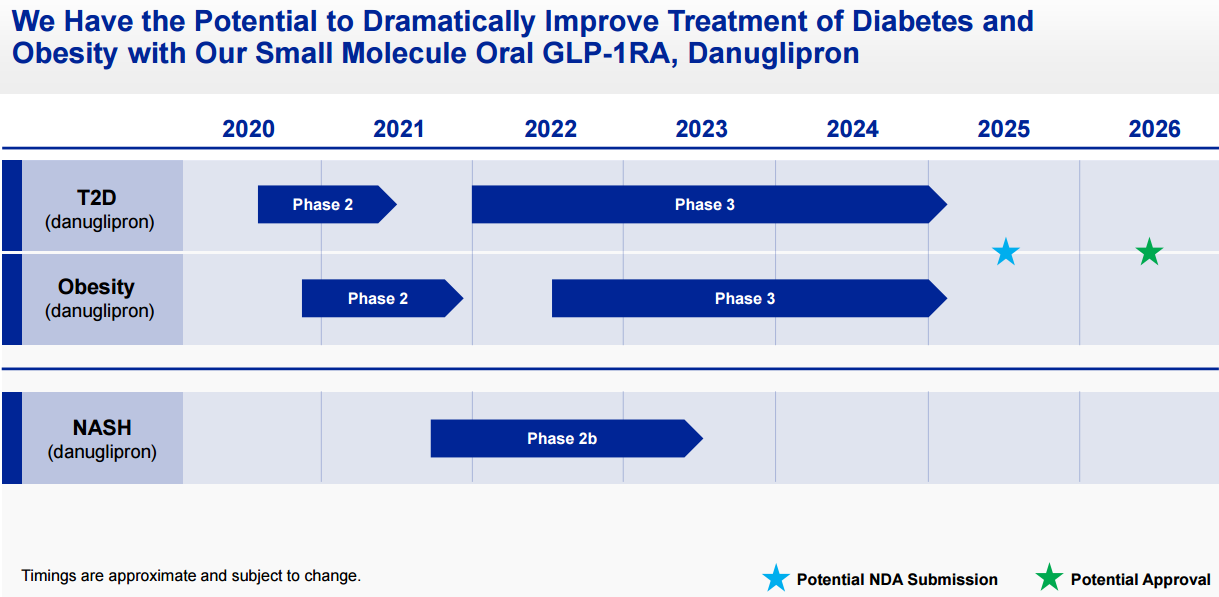
目前辉瑞已经启动II期临床研究,以检验danuglipron在治疗糖尿病患者时的效果,预计概念验证结果有望在第三季度获得。该公司还将启动IIb期临床试验,检验这款口服小分子GLP-1受体激动剂在治疗NASH患者时的功效。
此前诺和诺德Rybelsus(口服司美格鲁肽,每日1次)已获FDA批准上市,是目前唯一上市的一款GLP-1受体激动剂口服制剂。


