Advanced Materials:中山大学曹庆东/黄曦/霍雯雯制备遗传可编程细胞囊泡增强CAR-T疗法实体瘤治疗效果
时间:2023-03-01 10:19:51 热度:37.1℃ 作者:网络
iNature
CAR-T细胞疗法在根除血液系统恶性肿瘤方面取得了显着成功。然而,免疫抑制性肿瘤微环境的存在使其在实体瘤方面的治疗功效一直受到限制。
2023年2月22日,中山大学曹庆东、黄曦及霍雯雯共同通讯在Advanced Materials在线发表题为“Genetically Programmable Vesicles for Enhancing CAR-T Therapy against Solid Tumors”的研究论文,该研究表达高亲和力抗PD-L1 单链抗体(抗PD-L1 scFv)并负载谷氨酰胺拮抗剂的遗传可编程细胞囊泡(D@aPD-L1 NVs),以代谢方式破坏免疫抑制肿瘤微环境,并提高原位肺癌中抗间皮素CAR-T细胞的效率。
由于抗PD-L1 scFv可以特异性结合肿瘤细胞上的PD-L1,D@aPD-L1 NVs能够将谷氨酰胺拮抗剂靶向递送到肿瘤部位,干扰PD-1/PD-L1抑制信号传导,并解决谷氨酰胺拮抗剂和CAR-T细胞治疗引起的肿瘤细胞PD-L1上调,防止CAR-T细胞过早衰竭。更重要的是,D@aPD-L1 NVs能够有效减少免疫抑制细胞的数量,促进肿瘤组织中炎症细胞的募集和炎性细胞因子的分泌。D@aPD-L1 NVs提高了CAR-T细胞的浸润和效应功能,最终增强了CAR-T细胞的抗肿瘤能力和长期记忆免疫能力。总之,该结果表明D@aPD-L1 NVs是一种增强CAR-T细胞治疗实体瘤功效的潜在药物。

嵌合抗原受体-T(CAR-T)细胞疗法是指通过基因工程技术,将编码特定抗原识别域和T细胞激活信号的遗传物质导入T细胞,形成CAR-T细胞来介导肿瘤杀伤。CAR-T细胞在治疗血液肿瘤方面取得了极大成功,但由于实体瘤肿瘤微环境(TME)对CAR-T细胞的显着抑制,其在实体瘤治疗领域的应用前景仍面临一定挑战。
由于肿瘤细胞与浸润肿瘤内部的CAR-T细胞竞争营养,肿瘤细胞的过度生长则通过营养捕获将TME重塑为代谢抑制性微环境,导致CAR-T细胞的衰竭。此外,免疫抑制细胞和免疫检查点会明显减弱TME中CAR-T细胞的浸润和效应功能。因此,通过改善肿瘤免疫代谢来对抑制性TME进行重新编程,从而增强CAR-T细胞的浸润和效应功能,对于增强其实体瘤治疗效果至关重要。
在肿瘤演变过程中,代谢重编程导致肿瘤微环境被进一步重塑,以满足肿瘤生长的物质和能量需求。从这个角度来看,营养剥夺会导致肿瘤细胞死亡。然而,这些被抑制的代谢途径也可能发生在免疫细胞中,因而损害免疫细胞的抗肿瘤能力,从而减弱潜在的抗肿瘤效果。Reinfeld等发现,肿瘤微环境中的免疫细胞偏好葡萄糖,肿瘤细胞偏好谷氨酰胺,因而谷氨酰胺是一个重要的代谢节点。此外,由于肿瘤细胞和效应T细胞的谷氨酰胺代谢途径存在差异,抑制肿瘤微环境中的谷氨酰胺代谢可有效抑制肿瘤细胞的生长。
6-重氮-5-氧代-L-正亮氨酸(DON)是一种结构类似于谷氨酰胺的非天然氨基酸,其因活性重氮基团的存在,不仅抑制谷氨酰胺酶,而且抑制需要谷氨酰胺的多种酶。临床前模型已证明DON可有效抑制肿瘤细胞生长、缩小肿瘤大小,并提高体内存活率,几个临床试验中也显示出一定疗效。已有研究表明, DON上调效应T细胞中的氧化代谢以分化成活化的T细胞表型,继而达到抑制肿瘤增殖目的。同时,DON还可以抑制髓源性抑制细胞(MDSCs)的产生和募集,促进抗肿瘤炎症巨噬细胞的产生,增强效应T细胞的浸润。因此,利用谷氨酰胺拮抗剂对代谢微环境进行重编程和调节TME效应,对于增强CAR-T细胞治疗实体肿瘤的功效意义重大。
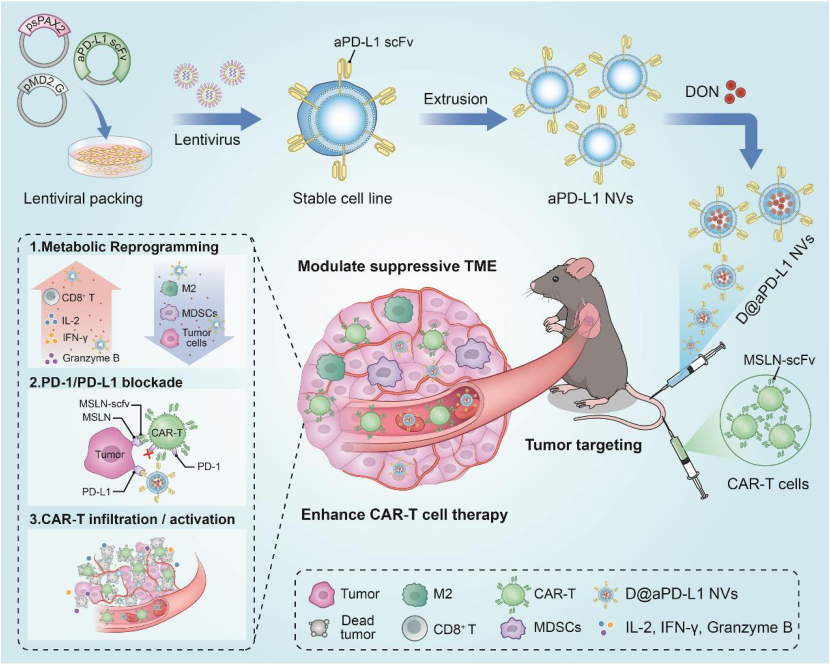
图1 D@aPD-L1 NVs增强CAR-T治疗实体瘤作用示意图(摘自Advanced Materials )
然而,利用谷氨酰胺拮抗剂增强CAR-T细胞治疗效果仍有一定限制,靶向性缺乏导致的严重全身副作用限制了其临床应用。此外,谷氨酰胺拮抗剂给药通常上调肿瘤细胞PD-L1的表达,将通过与CAR-T细胞上的PD-1结合而导致CAR-T细胞过早衰竭。因此,如何将谷氨酰胺拮抗剂精确输送到肿瘤微环境中,并解决治疗过程中引起的PD-L1表达上调,对于增强CAR-T细胞的抗肿瘤作用至关重要。
细胞膜衍生纳米囊泡(NVs)具备良好的生物相容性、易修饰性和穿越生物屏障的能力,已成为一种潜在的药物递送载体。NVs可以继承基因工程细胞细胞膜的结构和功能,继而作为生物活性药物载体来装载用于靶向治疗的化疗剂或免疫治疗剂,增加局部药物的浓度,同时降低全身性毒副作用。纳米囊泡还可以携带全长抗体、受体或配体,同时保留其天然结构和功能,使其能够执行生物任务并提供靶向递送。如该团队设计了表达双特异性抗体的纳米囊泡,用于将雷地昔韦靶向递送至冠状病毒,不仅降低了雷地昔韦的副作用,对冠状病毒也显示出良好的中和能力和治疗效果。
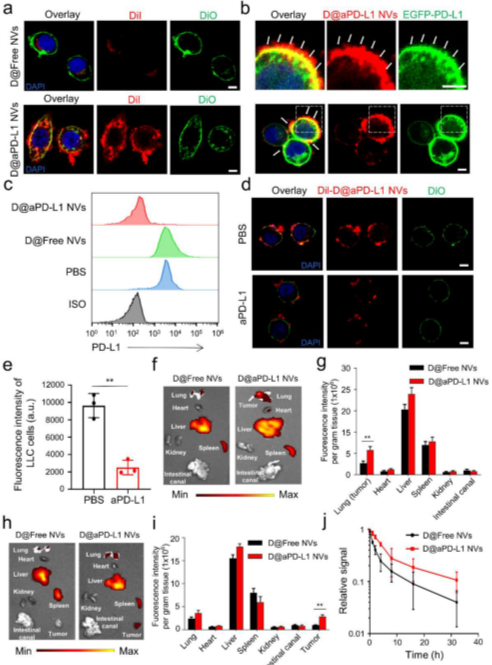
图2 D@aPD-L1 NVs的体外生物学行为和体内生物分布(摘自Advanced Materials )
该研究设计并制备了表达高亲和力抗鼠PD-L1抗体的细胞纳米囊泡(aPD-L1 scFv),并装载谷氨酰胺拮抗剂(D@aPD-L1 NVs)以提高CAR-T细胞抗实体瘤的活性。由于aPD-L1 NVs能够靶向过量表达PD-L1的肿瘤,因此可作为载体将谷氨酰胺拮抗剂靶向递送至TME,从而避免谷氨酰胺拮抗剂的全身毒副作用。此外,由于aPD-L1 scFv可以通过结合肿瘤细胞表面的PD-L1来阻断PD-1/PD-L1的免疫抑制信号轴,因此有望解决使用谷氨酰胺拮抗剂和CAR-T细胞引起的肿瘤细胞PD-L1表达上调的问题。
更重要的是,通过靶向TME中的谷氨酰胺代谢,D@aPD-L1 NVs可显着降低MDSCs和M2巨噬细胞的比例。同时,肿瘤组织中内源性CD8+ T细胞的浸润、CD8+GzmB+ T细胞的比例以及促炎细胞因子IFN-γ和IL-2的水平也得到改善。将抗炎TME重塑为促炎状态有利于增强CAR-T细胞在肿瘤组织中的存活、浸润和抗肿瘤能力。研究表明,D@aPD-L1 NVs的独特特性征提高了CAR-T细胞治疗原位肺癌的效果,显着降低了肿瘤复发率,为增强CAR-T细胞治疗实体肿瘤的功效提供了新的研究视角。


