Nat Commun:肠道,而非神经或其他组织,是胰岛素信号通路调控衰老的主要场所
时间:2022-11-18 20:53:30 热度:37.1℃ 作者:网络
2022年10月25日,北京生命科学研究所/清华大学生物医学交叉研究院董梦秋实验室在Nature Communications杂志在线发表了题为Intestine-specific removal of DAF-2 nearly doubles lifespan in Caenorhabditis elegans with little fitness cost的研究论文[1]。论文作者发现,只要在肠道这一种组织中降低胰岛素信号通路活性,就可以使线虫的寿命几近翻倍,而且避免了降低全身所有组织的胰岛素信号通路活性而造成的对生殖和发育的严重影响。
胰岛素/胰岛素样生长因子1信号通路 (Insulin/IGF-1 Signaling pathway, 简称IIS或胰岛素信号通路)是第一个被发现且得到广泛验证的衰老调控信号通路[2]。降低胰岛素信号通路活性可以显著延长线虫、果蝇和小鼠的寿命,而且IIS基因在人群中的多态性与长寿表型之间存在紧密联系。因此,IIS调控衰老具有高度的进化保守性,理解 IIS如何影响线虫寿命对于理解衰老调控有重要价值。本文作者运用基因组编辑技术和荧光蛋白标签确定了线虫胰岛素信号通路上游受体酪氨酸激酶DAF-2 和下游FOXO转录因子DAF-16的时空表达谱,进而使用植物生长素诱导的蛋白质降解技术解析了不同组织的IIS对寿命调控的贡献。论文报道的关键发现(图 1)以及对衰老研究的意义有以下几点。
1) 发现只有在肠道而非其它组织中降低IIS通路活性才能大幅度延长线虫寿命;纠正了有22年历史、近两年有四篇研究论文助推的关于神经细胞是IIS调控寿命的枢纽的错误认知[3-7];澄清了实验结果出现偏差的部分原因,即有的神经“特异性”启动子不够特异,在肠道细胞有泄漏表达。
2) 发现特异性去除肠道细胞中的胰岛素受体蛋白不仅使线虫寿命延长 94%,接近于经典的daf-2(e1370)突变体的长寿程度(延长106%),而且很大程度上避免了daf-2(e1370) 线虫所遭遇的发育受阻、产卵量减少这两大副作用。这表明长寿并非一定要以生殖和发育为代价。
3) 发现降低肠道细胞的IIS通路活性会导致线虫体内蛋白质及RNA的合成代谢的下降。此前多篇文章报道,蛋白质合成代谢降低有利于长寿。董梦秋实验室2021年发表的工作表明,daf-2突变体通过增强eIF2a S49位点磷酸化抑制蛋白质合成,由此实现了~40%的寿命延长,其余 ~60%由其它机制贡献[8]。之前的研究没有充分注意到的是,daf-2长寿突变体大幅度减少RNA合成以及RNA合成代谢的下降有利于长寿。
4) 限制(肠道细胞的)胰岛素信号通路活性和限制饮食是两种最保守且最稳健的延缓衰老的方式。过去的衰老生物学研究侧重强调它们导致了相似的下游效应,如蛋白质合成代谢降低;本研究则指出它们很可能具有共同的发端—营养供应或感知的改变。因此,本文的发现有助于聚焦日益发散的衰老调控机制研究,提示衰老研究应该更多关注营养和代谢在衰老中的作用。
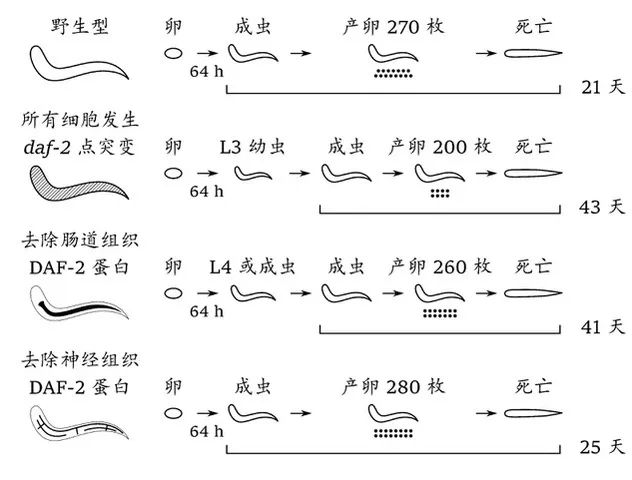
图1. 特异性降低肠道中IIS的活性可以使线虫寿命几近翻倍而且不影响发育和生殖。
另外,本文回答了一个衰老领域29 年悬而未决的问题。1993年Cynthia Kenyon 发现daf-2基因突变使线虫寿命翻倍,由此打开了衰老分子调控机理研究的序幕。但是,daf-2基因在哪些细胞中表达却一直不清楚。daf-2基因表达量低、转录起点多、内含子多、剪接异构体多、编码区长(50 kb),这些都不利于表达定位。
本文利用daf-2所有mRNA异构体都共享3’ 序列这一特点,通过基因原位编辑在3’端引入SL2反式剪接序列和携带双重核定位信号的串联绿色荧光蛋白报告基因(称为Nuclear ultrabright GFP::mNeonGreen, 简称NuGFP)。NuGFP元件随被标记基因共转录,反式剪切后产生彼此独立的被标记基因mRNA 与NuGFP mRNA,各自被翻译成蛋白,互不影响。借助于聚集到细胞核中的高强度NuGFP荧光信号,作者发现daf-2在线虫全身广泛表达 (图 2)。这个方法具有通用性,可服务于其它线虫基因的内源表达定位研究。
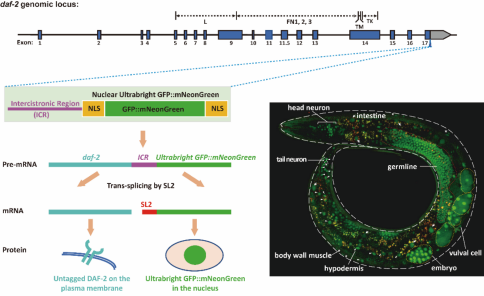
图2. daf-2基因在线虫体内广泛表达。
董梦秋实验室的张艳苹博士和张文红博士是本文的共同第一作者。董梦秋研究员为本文的通讯作者。其他作者包括原董梦秋实验室的张攀博士,首都师范大学的张少兵教授及博士生李奇,北京生命科学研究所影像中心的占成博士和孙越,以及北京生命科学研究所核酸测序中心的蔡涛博士和王家文博士。该研究工作由科技部和北京市科委资助,在北京生命科学研究所完成。
参考文献:
1. Zhang, Y.P., et al., Intestine-specific removal of DAF-2 nearly doubles lifespan in Caenorhabditis elegans with little fitness cost. Nat Commun, 2022. 13(1): p. 6339.
2. Kenyon, C.J., The genetics of ageing. Nature, 2010. 464(7288): p. 504-12.
3. Wolkow, C.A., et al., Regulation of C. elegans life-span by insulinlike signaling in the nervous system. Science, 2000. 290(5489): p. 147-50.
4. Aghayeva, U., et al., DAF-16/FoxO and DAF-12/VDR control cellular plasticity both cell-autonomously and via interorgan signaling. PLoS Biol, 2021. 19(4): p. e3001204.
5. Venz, R., et al., End-of-life targeted degradation of DAF-2 insulin/IGF-1 receptor promotes longevity free from growth-related pathologies. Elife, 2021. 10.
6. Uno, M., et al., Neuronal DAF-16-to-intestinal DAF-16 communication underlies organismal lifespan extension in C. elegans. iScience, 2021. 24(7): p. 102706.
7. Roy, C., et al., DAF-2/insulin IGF-1 receptor regulates motility during aging by integrating opposite signaling from muscle and neuronal tissues. Aging Cell, 2022: p. e13660.
8. Li, W.J., et al., Insulin signaling regulates longevity through protein phosphorylation in Caenorhabditis elegans. Nat Commun, 2021. 12(1): p. 4568.


